Углеродное раскисление в вакууме. Понижение давления в системе существенно влияет на развитие процессов, протекающих с образованием газовой фазы, в частности процесса окисления углерода. Окисление углерода в вакууме происходит в результате его взаимодействия с растворенным в стали кислородом:
[ С ] + [ О ] = СО, (1)
Как видно из уравнения, в условиях равновесия при окислении углерода содержание кислорода в металле пропорционально парциальному давлению СО. Образование пузырьков СО в процессе окисления углерода возможно лишь тогда, когда давление его образования (рсо в уравнении) достигает внешнего давления на пузырек Рпуз., состоящего из атмосферного Рат, и ферростатического Рф давлений2 а также давления поверхностного натяжения, равного 2σ/r ( где σ – поверхностное натяжение, r – радиус пузырька).
Рпуз. = Рат + Рф + 2σ/r (3)
Из уравнения (Рпуз. = Рат + Рф + 2σ/r) следует, что с уменьшением атмосферного давления, т.е. созданием вакуума, уменьшается давление на пузырек и соответственно уменьшается парциальное давление СО. Пропорционально этому, согласно уравнению 2 , понижается и равновесное с углеродом содержание кислорода. Таким образом, при понижении давления в системе возрастает химическое сродство углерода к кислороду. Поэтому в вакууме получает более полное развитие реакция окисления углерода – происходит углеродное раскисление стали. При
низком давлении углерод становится сильным раскислителем. Например, в условиях равновесия уже при давлении в системе 10 кПа углерод более сильный раскислитель, чем кремний, а при обычном для внепечной обработки в вакууме давлении 0,1 кПа – и более сильный, чем алюминий. (рис)
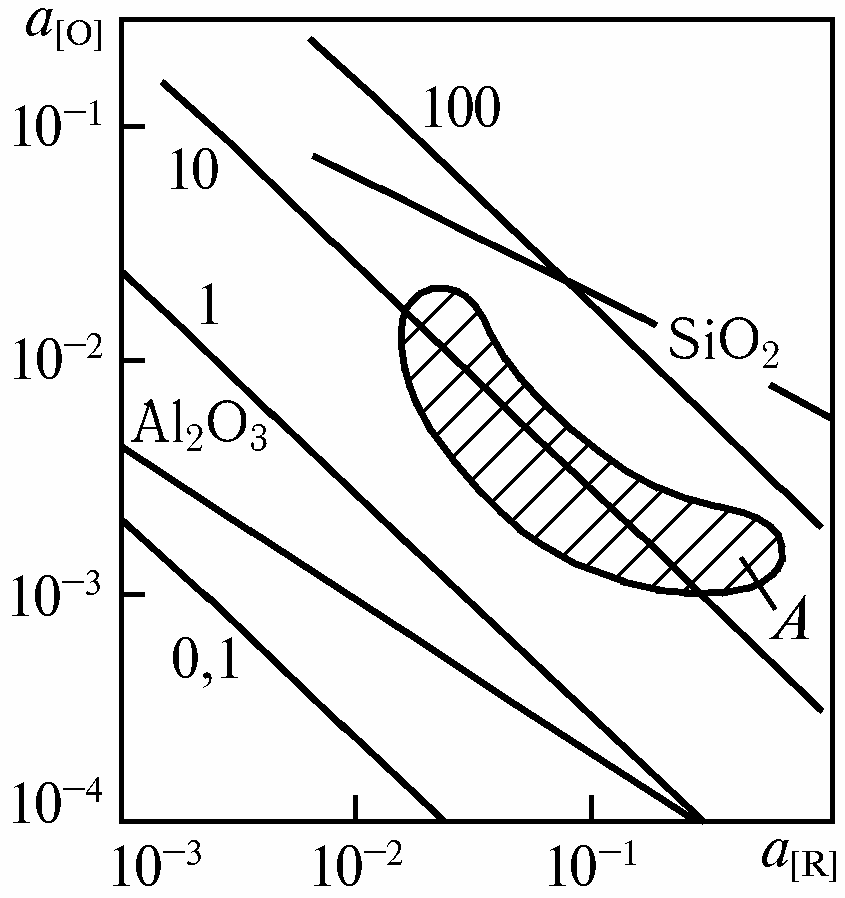
Рис. Зависимость активности кислорода a[O] в стали от активности раскислителя a[R] при 1873 К. Цифры у прямых – РСО, кПа; А – область a[O], достигаемых
при вакуумировании стали
Однако в реальных условиях внепечной обработки стали такое закономерное пропорциональное понижение содержания кислорода в металле и, соответственно, величины произведения [С]*[О]=m наблюдается лишь при понижении давления до 10кПа в условиях вакуумирования жидкой углеродистой стали (рис. область А), и до 1кПа при обработке вакуумом жидкой нержавеющей стали. Дальнейшее понижение давления не вызывает соответствующего уменьшения величины произведения [С]*[О]=m и раскислительная способность углерода практически не возрастает. Повышение раскислительной способности углерода при вакуумировании жидкой стали с понижением давления лишь до определенных значений объясняется особенностями процесса раскисления углеродом.
При зарождении в гомогенной жидкости газовый пузырек вследствие малого радиуса испытывает огромное капиллярное давление (давление поверхностного натяжения – σ/ r в уравнении (3)). Это приводит к тому, что реакция окисления углерода в гомогенной среде не получает развития. Она протекает на имеющихся межфазных поверхностях. Здесь пузырек может достигнуть критического размера, когда внешнее давление, состоящее из атмосферного, ферростатического и капиллярного, не превышает давления выделения СО вследствие химической реакции. Но и на межфазной поверхности при зарождении пузырька СО на него действует значительное капиллярное давление, что приводит к определенному перенасыщению металла углеродом и кислородом по сравнению с равновесными концентрациями. С понижением атмосферного и ферростатического давлений на пузырек возрастает роль капиллярного давления и при некотором достаточно низком значении двух первых слагаемых общего давления
на пузырек решающее значение в развитии реакции окисления углерода имеет капиллярное давление. Поэтому дальнейшее понижение атмосферного давления не оказывает существенного влияния на концентрации углерода и кислорода в металле.
О роли капиллярного давления свидетельствует приведенный ранее пример: предельное давление, до которого наблюдается его влияние на раскислительную способность углерода, для железа равна примерно 10 кПа, а для нержавеющей стали, обладающей заметно более низким поверхностным натяжением, эта зависимость сохраняется до 1кПа.
В связи с изложенным, если обработка расплава вакуумом преследует цель использовать главным образом преимущества углеродного раскисления, то нет необходимости создавать в агрегате глубокий вакуум. Достаточным будет снижение давления от 100 до 0,1–0,2 кПа, которое обычно легко осуществляется при помощи самых простых насосов. Уменьшение же давления ниже 0,1 кПа требует значительных затрат, а его влияние на условия раскисления углеродом асимптотически приближается к нулю.
Однако и при достигаемой в промышленных условиях степени раскисления углеродом в вакууме (рис) он все же при содержании более примерно 0,1 % оказывается более сильным раскислителем, чем кремний, и сопоставим с раскисляющим действием алюминия при обычном содержании этого элемента в стали до 0,01 %.
Повысить раскислительную способность углерода в вакууме можно, облегчая условия выделения углерода введением в металл готовых газовых пузырьков, например продувкой нейтральным газом. Согласно экспериментальным данным продувка металла аргоном позволяет заметно понизить давление, при котором наблюдается его влияние на степень раскисления, т.е. увеличить раскислительную способность углерода. Так, при одинаковых условиях содержание кислорода в металле после вакуумирования в спокойном состоянии соответствовало равновесному давлению СО 16 кПа, после вакуумирования с перемешиванием – 4,5 кПа, а при вакуумировании с продувкой аргоном – 3 кПа.
Вследствие трудности зарождения пузырьков СО окисление углерода происходит на межфазных поверхностях. Поэтому скорость обезуглероживания при вакуумировании лимитируется массопереносом у этой поверхности. Как показали исследования, при низком содержании углерода (менее ∼0,1 %) скорость его окисления лимитирует массоперенос углерода, а при более высоком содержании углерода – массоперенос кислорода. Следовательно, согласно первому закону Фика скорость процесса при содержании углерода менее и более ∼0,1 % определяется, соответственно, уравнениями
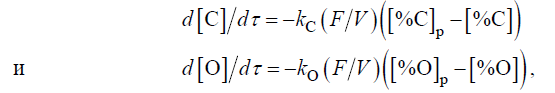
где τ – время, с; kC и kО – соответственно коэффициенты массопереноса углерода и кислорода, м/с; р – индекс, указывающий состояние равновесия; FV – отношение поверхности к объему, м–1.
Как видно из этих уравнений , скорость углеродного раскисления увеличивается с увеличением относительной поверхности контакта металла и газовой фазы и коэффициента массопереноса, который возрастает с повышением интенсивности перемешивания.
Раскисление углеродом в вакууме оказывает влияние и на другие процессы рафинирования стали. Барботаж металла пузырьками СО способствует дегазации стали и флотации неметаллических включений, т.е. рафинированию от кислорода, водорода, азота и неметаллических включений
Процессы дегазации. Из элементов, находящихся в обычных условиях при комнатной температуре в газообразном состояии, в жидких стали растворены кислород, водород и азот. Прямое удаление из металла кислорода при обработке вакуумом практически невозможно, т.к. парциальное давление кислорода, равновесное с насыщенным раствором кислорода даже в чистом железе, при 1600 °С составляет величину порядка 0,6 мПа, что с учетом содержания кислорода в воздухе 21 % соответствует общему давлению 2,9 мПа. Удаление кислорода из жидкой стали, содержащей элементы, которые понижают коэффициент активности кислорода, возможно при более низком давлении, но в практике внепечной обработки стали вакуумом не используются такое низкое давление. Удаление растворенных в стали газов при обработке вакуумом обусловлено уменьшением их парциального давления в атмосфере с уменьшением общего давления над металлом.
Растворимость водорода и азота в жидком железе по закону Сивертса пропорциональна корню квадратному их парциального давления:
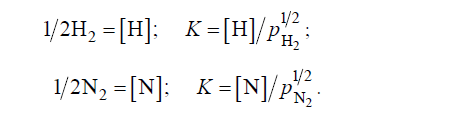
Необходимо, однако, учитывать, что такое соотношение соблюдается лишь в том случае, когда двухатомный газ находится в растворе в виде простых частиц – атомов или ионов. При наличии химических связей между частицами растворенного газа и компонентами расплава наблюдаются от-клонения от закона Сивертса. Поэтому соотношения, описываемые этим законом, в практике сталеплавильного производства справедливы лишь для водорода, а для азота, который может взаимодействовать с компонентами расплава, часто наблюдаются заметные отклонения от закона Сивертса. К тому же ряд элементов (Cr, V, Al), которые в жидкой стали не связывают азот в нитриды, понижают коэффициент активности азота, уменьшая возможность его удаления.
Удаление растворенных в металле водорода и азота возможно по трем механизмам: 1) образование газовых пузырьков в металле и их всплывание; 2) удаление (десорбция) с поверхности раздела металл–атмосфера; 3) образование пузырьков на межфазной твердой поверхности и их всплывание. Как было показано при рассмотрении реакции окисления углерода, гомогенное зарождение пузырьков СО невозможно вследствие большого капиллярного давления. Еще менее вероятна возможность образования в жидком металле пузырьков водорода или азота, концентрация которых весьма мала. Как будет показано, она обычно недостаточна для преодоления даже одного ферростатического давления на глубине уже нескольких сантиметров. Поэтому первый из указанных механизмов не реализуется.
Процесс десорбции водорода и азота из жидкой стали можно представить состоящим из трех стадий:
1. Перенос растворенных в металле водорода и азота из объема к поверхности раздела с газовой фазой.
2. Адсорбция атомов водорода и азота в поверхностном слое жидкого металла: [H] = Hпов;
[N] = Nпов
3. Молизация адсорбированных атомов в молекулы и переход их в газовую фазу: 2Hпов=H2;
2Nпов=N2
Скорость первой и второй стадий описывается уравнением первого порядка:
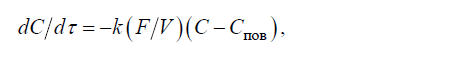 (8)
(8)
где(C−Спов) – градиент концентраций растворенного вещества равновесной в данный момент времени; k – константа скорости; F и V – соответственно поверхность и объем металла.
Скорость третьей стадии описывается уравнением второго порядка:
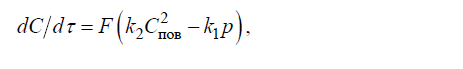
(9)
где k1 и k2 – константы скорости прямой и обратной реакций; p – парциальное давление газа над расплавом.
Когда эта стадия является самой медленной, то C=Cпов, так как концентрации газа в объеме и на поверхности успевают выравниваться. Экспериментально установлено, что скорость удаления газов из металла описывается уравнением первого порядка. Следовательно, лимитирующей стадией рассматриваемого процесса является первая или вторая стадия. На основе закономерностей формальной кинетики трудно разделить влияние адсорбционных и диффузионных процессов. Даже влияние поверхностно-активных элементов (О, S) на процесс дегазации, используемый часто для оценки адсорбционной стадии, не является убедительным доводом в пользу этой стадии. Ведь поверхностное сгущение таких элементов вызывает уменьшение активной поверхности расплава, что согласно уравнению (9) приводит к замедлению переноса веществ. Поэтому по результатам экспериментальных данных принимают, что лимитирует процесс дегазации жидкого металла диффузионно-адсорбционная стадия, скорость которой описывается кинетическим уравнением (8). Интегрирование этого уравнения приводит к уравнению:
С = Ср + (Со – Ср)exp(-kF/V)τ, (10)
где C0 – исходная концентрация (при τ=0)
Как видно из уравнения (10), время τ дегазации стали до заданной концентрации примеси с данными исходной и равновесной ее концентрациями уменьшается с увеличением константы скорости k и величины относительной поверхности F/V. Константу скорости можно увеличивать повышением интенсивности перемешивания, а относительную поверхность – уменьшением объема металла.
Образование пузырей на твердой межфазной поверхности (третий механизм) происходит при наличии на ней пор, размер которых должен быть достаточно велик для образования пузырька, имеющего радиус не менее критического, т.е. способного к самопроизвольному росту и, вместе с тем, достаточно мал, чтобы он не заполнялся жид-ким металлом. Первое из этих условий было рассмотрено при изучении реакции окисления углерода, второе определяется углом смачвания твердой поверхности жидким металлом.
Условия образования пузырьков газа на твердой поверхности показаны графически на рис. Они возможны в области левее сплошных линий 1–4, определяющих условие зарождения пузырьков, соответственно H2 или СО, не менее критического радиусе штрих-пунктирных линий 5, 6, определяющих возможность наличия пор, не заполенных жидким металлом.
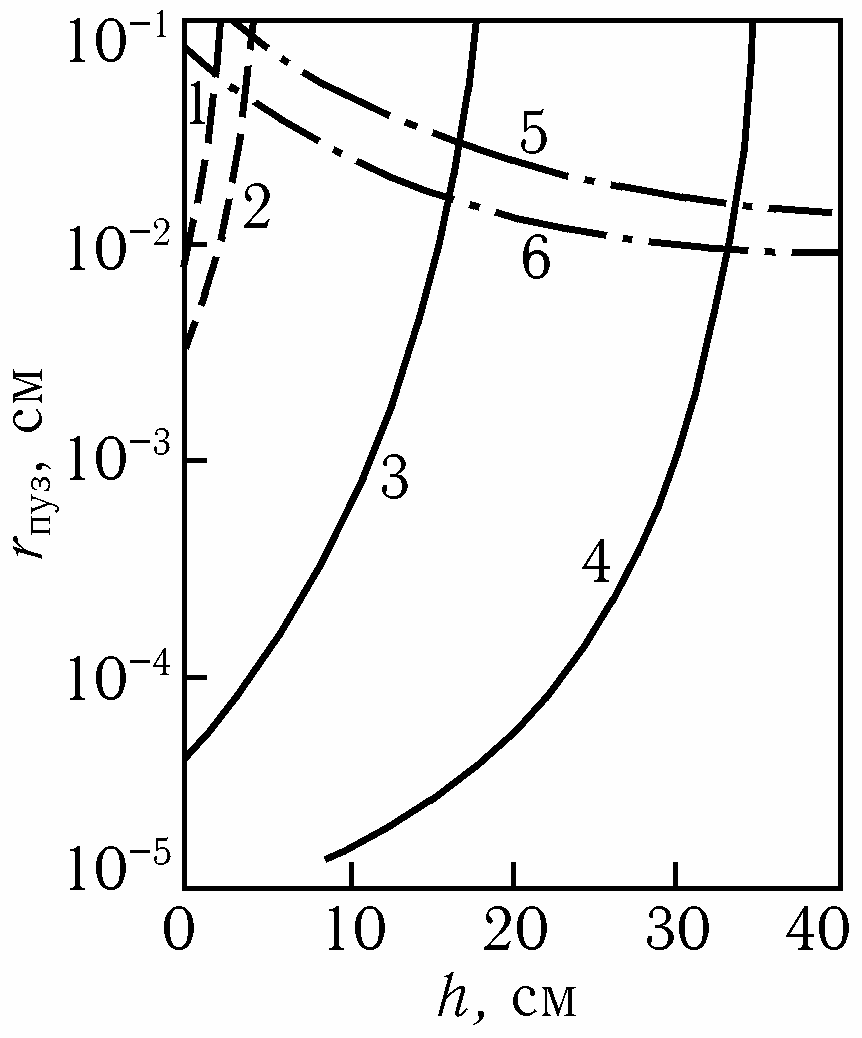
Рис. Зависимость радиуса пор при образовании пузырей в огнеупорной кладке от глубины ванны и равновесного содержания водорода в металле, %: 4·10–3 (1), 5·10–4 (2), или равновесного рСО (3 – 13 кПа, 4 – 26 кПа). Угол смачивания, град.: 10 (5), 60 (6)
Как видно на рис., образование пузырьков водорода (кривые 1, 2 и 5, 6) на твердой поверхности делается невозможным уже на глу-бине в несколько сантиметров. Пузырьки СО могут образовываться на глубине в десятки сантиметров (кривые 3, 4 и 5,6).
Повышение интенсивности перемешивания металла способствует доставке реагентов к порам и отрыву пузырьков от твердой поверхности, что ускоряет процесс. Это же происходит при увеличении относительной поверхности контакта жидкой и твердой фаз, а также шероховатости последней.
Кроме трех перечисленных механизмов дегазации возможен еще один – переход газов из раствора (водород, азот) или вследствие химической реакции (СО) в готовые газовые пузырьки. Этот механизм в значительной мере реализуется при продувке жидкой стали аргоном.