2. Металлы, их свойства и классификация
Металлы являются наиболее распространенным видом материалов, которыми человек удовлетворяет свои жизненные потребности. Сейчас человечество живет в век металлов и развитие всех отраслей промышленности, наука, культура и быт человека немыслимы без машин, механизмов, приборов и других изделий из металла.
Введение
Переход человека от использования камня (каменный век) к металлу был длительным и сложным. Он произошел не в результате революционного скачка в развитии общества, а металлы постепенно входили в обиход человека в течение длительного периода. Первым металлом, вошедшим в повседневный обиход человека, была медь, которая открыла эру металлургии и дала миру первый сплав – бронзу. По археологическим данным первые сведения о плавках меди относятся к 6500–5700 гг. до н.э. Она была основой материальной культуры в течение тысячелетий, и медный век постепенно перешел к бронзовому веку.
Следующим этапом в металлургии стало применение железа (железный век) и его начало относят ко второму тысячелетию до н.э. Получение чистого железа и его сплавов стало возможным благодаря накопленному опыту по выплавке меди, бронзы, золота и других легкоплавких металлов и сплавов. Освоение производства железа послужила мощным толчком к развитию производительных сил и технического прогресса. В древности человеку были известны восемь металлов – медь, золото, серебро, олово, свинец, железо, ртуть и сурьма. К концу XVIII в. их число увеличилось до 20, а в настоящее время производится и используется около 80 металлов.
Распространенность элементов в земной коре различна – от нескольких процентов до миллионных долей. Суммарное содержание десяти наиболее распространенных элементов (кислород – 47,00; кремний – 29,50; алюминий – 8,05; железо – 4,65, кальций – 2,96; натрий – 2,50; калий – 2,50; магний – 1,87; титан – 0,45; водород – 0,15) составляет 99,63 % массы земной коры, а на все остальные элементы приходится только 0,37 % общей массы земли. Представление о распространенности в земной коре некоторых хорошо известных металлов дают значения их кларков, т.е. среднеарифметическое содержание в земной коре, которые приведены ниже (%):

Наиболее редко в природе встречаются полоний и актиний, кларк которых близок к 10–15 %.
Техническое значение металла определяется его распространенностью в природе, потребностями в народном хозяйстве и производственными возможностями получения. Два последних фактора определяют масштабы производства отдельных видов металла. В производстве металлов около 95 % выпускаемой продукции (около 800 млн. т.) составляют чугун и сталь, которые представляют собой сплавы железа с углеродом и другими легирующими компонентами. Ежегодный выпуск основных цветных металлов находится на уровне (млн. т.): алюминий 23–24; медь 10–11; никель 0,5–0,7; свинец 4–5; цинк 5–6; магний 0,2–0,3; олово 0,20–0,25; молибден 0,14–0,15; титана около 0,1.
Производством металлов из руд и других видов металлосодержащего сырья занимается металлургия – крупнейшая отрасль тяжелой индустрии. Металлургия является центральным звеном горнометаллургического производства, включающего геологию, горное дело, обогащение, собственно металлургию, литейное производство и обработку металлов различными приемами (давлением, температурой, механическими методами и т.д.). В основе металлургии лежат принципы химических технологий, так как при осуществлении металлургических процессов перерабатываемые материалы претерпевают различные физико-химические превращения. Поэтому металлургия тесно связана с физикой, химией и особенно с физической химией, которая является научной основой теоретической и практической металлургии. В последние годы возрастает связь металлургии с математикой и компьютерной техникой.
Металлургическая промышленность России в настоящее время производит 78 элементов Периодической системы Д.И. Менделеева, а также различные виды удобрений, строительных материалов, серной кислоты и серы, цемента и многих других видов продукции. Металлургия России является высокоразвитой отраслью материального производства. Особое значение для развития горнозаводского дела в России имели труды M.B. Ломоносова, Д.И. Менделеева, а также крупных специалистов по производству черных металлов П.П. Аносова, Д.К. Чернова, Н.Н. Бекетова, И.П. Бардина и многих других. Неоценимый вклад в развитие отечественной цветной металлургии внесли А.А. Байков, НС. Курнаков, П.П. Федотьев, В.А. Ванюков, АИ. Беляев, И Ф. Худяков, АН Вольский и другие.
Большинство металлов обладает рядом свойств, имеющих общий характер и отличающихся от свойств других простых или сложных соединений. Такими свойствами являются сравнительно высокие температуры плавления большинства металлов, способность к отражению света, высокая теплопроводность и электропроводность, способностью к прокатыванию. Эти особенности объясняются существованием в металлах особого вида связи – металлической.
В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов и много незаполненных орбит. Кроме того, валентные электроны достаточно слабо связаны со своими ядрами и поэтому обладают большой свободой перемещения в кристаллической решетке металла. общая картина металлического состояния может быть представлена в следующем виде. Узлы кристаллической решетки металла заняты как отдельными атомами, так и ионами, между которыми сравнительно свободно перемещаются электроны, называемые иногда электронным газом (рис.1).
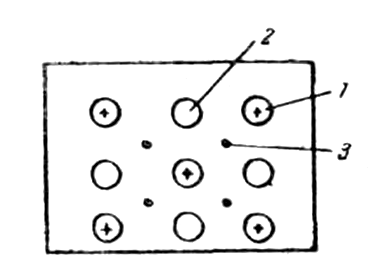 Рис. 1. Схема размещения атомов, ионов и электронов в кристаллических решетках металлов: 1 – атомы; 2 – ионы; 3 – электроны
Рис. 1. Схема размещения атомов, ионов и электронов в кристаллических решетках металлов: 1 – атомы; 2 – ионы; 3 – электроны
Поскольку валентные электроны распределены в кристалле металла почти равномерно, невозможно говорить о какой-либо направленности металлических связей. В этом состоит их важное отличие от ковалентных связей, которые имеют строгую направленность в пространстве. Металлическая связь отличается от ковалентной также и своей прочностью: ее энергия в 3–4 раза меньше энергии ковалентной связи. Существование подвижных электронов в кристалле металлов объясняет их характерные особенности (электропроводность, теплопроводность).
Металлическую связь можно определить как разновидность ненаправленной ковалентной химической связи, когда атомы имеют мало валентных электронов, много свободных орбит, а валентные электроны слабо удерживаются ядром
Таким образом, металлы – химические элементы, кристаллические решетки которых состоят из атомов и ионов, а в пространстве между ядрами свободно перемещаются электроны. Связь между атомами ковалентная, между ионами и электронами – металлическая.
Атомы постоянно теряют электроны, превращаясь в ионы, а последние принимают их, становясь атомами. Количество электронов, беспорядочно блуждающих в кристаллической решетке, подобно молекулам газа, у разных металлов различно, оно определяет долю металлической связи и меру металличности элемента.
Представление о кристаллической решетке – «погруженной в облако свободно блуждающих электронов», – впервые высказанное в 1902 г., теперь дополнено и приобрело несколько измененную трактовку; однако оно и в первоначальном упрощенном виде хорошо объясняет высокую электропроводность, теплопроводность и термоэлектронную эмиссию металлов.
На атомы и ионы в узлах кристаллической решетки действуют силы взаимного притяжения и отталкивания. Амплитуды колебания ионов и атомов зависят от температуры и возрастают с ней. При температуре плавления амплитуды колебаний столь велики, что решетка разрушается: атомы и ионы теряют свои постоянные места и переходят в беспорядочное движение, свойственное жидкому состоянию. Связь между ионами и электронами называют металлической, а между атомами – ковалентной. От соотношения этих видов химической связи зависит количество блуждающих электронов. Чем больше это количество, тем ярче выражены металлические свойства элементов.
Прочностью металлической связи объясняются многие физические и механические свойства металлов.
Внешние механические воздействия на металл вызывают сдвиг слоев кристаллической решетки, однако связь между ионами и электронами при этом не нарушается из-за свободной подвижности электронов. По этой причине металлы прочны и пластичны, они изменяют форму, но не теряют прочности. В меди и золоте много свободных электронов, металлическая связь значительно преобладает над ковалентной – эти металлы пластичны, ковки, вязки. У сурьмы и висмута свободных электронов сравнительно мало, поэтому они хрупки.
Некоторые физические и механические свойства наиболее распространенных цветных металлов приведены (таб.1).
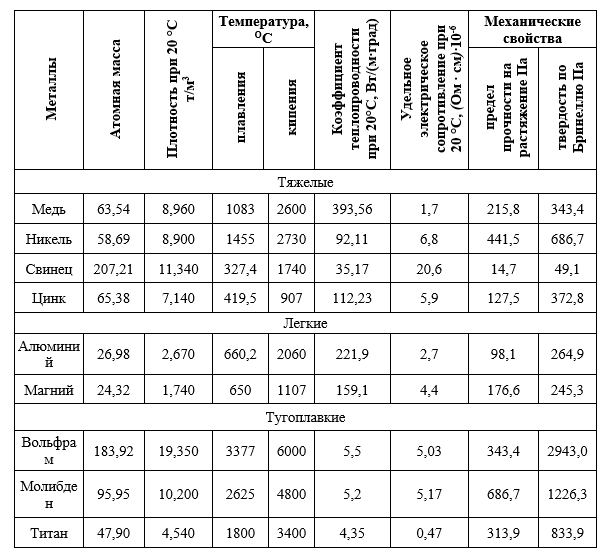 Таблица 1
Таблица 1
Физические и механические свойства наиболее распространенных, цветных металлов
Электропроводность, обусловленная перемещением в пространстве кристаллической решетки «обобществленных» электронов, очевидно, зависит от свободы их передвижения – правильности расположения атомов, амплитуды и частоты их теплового колебания. Действительно, с повышением температуры размах колебания узлов решетки увеличивается, рассеивание электронов усиливается, и электропроводность снижается; с охлаждением она снова возрастает. При температурах, близких к абсолютному нулю, электрическое сопротивление некоторых металлов и сплавов становится исчезающе малым. Необходимость очень низких температур пока затрудняет практическое использование этого ценного и интересного явления. Сверхпроводимость при минус 253 °С, обнаруженная в середине XX века у сплава ниобия, алюминия и германия, – редкое явление. Другой такой «высокотемпературный» сверхпроводник представляет собой сплав из ниобия и галлия.
Присутствие даже малых примесей других элементов понижает электропроводность: нарушая порядок в решетке, они рассеивают электроны. Также рассеивают электроны атомы, перемещенные в результате внешнего механического воздействия, – деформации ковкой, прокаткой или иной подобной обработкой.
Теплопроводность почти всегда изменяется с температурой подобно электропроводности – наиболее электропроводные металлы хорошо проводят тепло, а имеющие сравнительно высокое электрическое сопротивление – хуже. Теплопроводность связана как с колебаниями атомов в решетке, так и с движением свободных электронов. Последнее, по-видимому, имеет преобладающее значение.
Механические свойства – прочность на разрыв, сжатие, изгиб, твердость и пластичность объясняются не только металлической связью, но и особенностями кристаллической структуры металлов, имеющей в большинстве плотноупакованные пространственные решетки с высоким координатным числом. Наиболее типичные из них показаны (рис. 2), который надо понимать только как схему расположения атомных центров. В действительности, атомы, условно представляемые в виде шаров, плотно упакованы и занимают только 70 % объема (см. рис.2 г, 1).
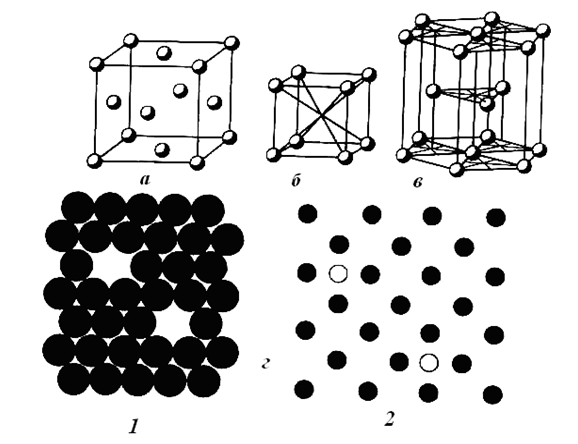 Рис. 2. Типичные кристаллические решетки металлов и дефекты структуры:
Рис. 2. Типичные кристаллические решетки металлов и дефекты структуры:
а – кубическая гранецентрированная решетка меди (аналогичны Аи, Ag, Al, Pt и др.); б – кубическая объемно-центрированная решетка вольфрама (аналогичны Fe, К. Ва и др.); в – гексагональная плотная решетка магния (аналогичны Zn, Be и др.); г – дефекты структуры: 1 – вакансии; 2 – междоузлия, включающие примесь
Многие металлы взаимно растворимы в жидком или твердом состояниях, либо образуют между собой химические – интерметаллические соединения, вследствие этого возникают иные кристаллические системы и широко изменяются свойства. Речь идет о сплавах, которые открывают простор получению новых ценных материалов с особыми свойствами. Уже применяют тысячи двойных, тройных и более сложных сплавов, которые получают не только смешиванием жидких металлов, но и спеканием порошков или растворением какого-либо элемента в поверхностном слое твердого металла (сплава).
Способность к упругим и пластическим деформациям, высокие электропроводность и теплопроводность, и некоторые другие особенности составляют комплекс свойств, не присущий иным твердым телам – дереву, камню, пластмассам. Этим и объясняется неоспоримое признание металлов и сплавов важнейшими материалами современной техники.
М. В. Ломоносов определял металлы как «…светлые тела, которые ковать можно». В наши дни, помимо дополнения этого признаками высокой электропроводности и теплопроводности, надо отметить и зависимость многих свойств от чистоты и механической обработки. Один и тот же металл может быть и ковким и хрупким. В реальных кристаллах всегда есть различные дефекты, из-за которых механические и другие физические свойства нельзя отнести только к особенностям металлической связи и кристаллической решетки.
Точечные дефекты – незаполненные узлы решетки, вакансии (см. рис. 2), а также узлы, занятые атомами примесей, возникают при кристаллизации из расплава. Линейные и плоские дефекты – дислокации получаются также при кристаллизации либо в результате механической обработки в виде неполных слоев атомов или их взаимного смещения, а иногда и переплетения.
Общее количество дефектов на 1 см2 площади металла или сплава часто превышает 106. Точечные дефекты снижают преимущественно электропроводность и теплопроводность, а другие – еще и механические свойства.
Обычные металлы и сплавы поликристалличны, они состоят из произвольно ориентированных совокупностей зерен. в каждом зерне элементарные кристаллы имеют одинаковую ориентацию, а в соседних – отличную, иногда расположенную под большими углами (рис. 3). На границах зерен скапливаются примеси и образуются газовые пустоты. Помимо понижения физических свойств, здесь наблюдается и меньшая коррозионная стойкость.
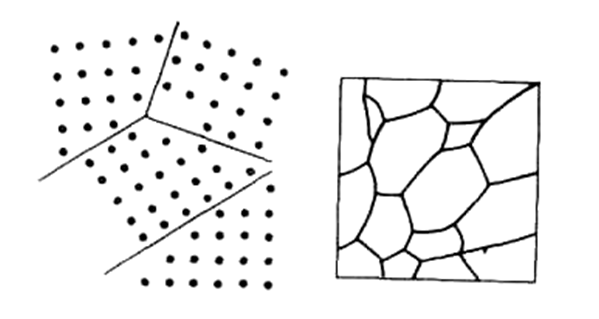 Рис. 3. Границы зерен металла, расположенные под большими углами
Рис. 3. Границы зерен металла, расположенные под большими углами
Возможность смещения слоев кристаллов по направлениям дислокаций или разрыв их на границах зерен понижают прочность. Прочность в известной мере возрастает после отжига – нагревания и медленного охлаждения, когда в результате диффузии дислокации частично устраняются, а зерна становятся мельче.
Механическая обработка иногда вызывает упрочнение, связанное с переплетением дислокаций. Другая причина существенного упрочнения, сопровождающегося понижением пластичности и появлением хрупкости, связана с возникновением или введением посторонних нерастворимых фаз, например, карбида железа F3C в стали или окислов и нитридов в титане, вольфраме, молибдене. Зерна этих соединений препятствуют взаимному смещению слоев металла. Очистка металлов от примесей обычно значительно улучшает ковкость и облегчает обработку.
Жидкие металлы отличаются от твердых металлов сравнительно малой связью между атомами и ионами, но свобода движения электронов и здесь сохранена, поэтому они также электропроводны и теплопроводны.
Один и тот же металл при разных температурах может иметь разные кристаллические решетки. Переход из одной системы в другую изменяет расстояние между узлами и их расположение, этот переход существенно отражается на свойствах полиморфных модификаций. Например, олово, известное при обычных температурах как пластичный блестящий металл тетрагональной сингонии с плотностью 7,29 г/см3 (β – модификация), при температурах ниже 13,2 °С, а особенно при быстром переохлаждении превращается в серый порошок, кристаллизуясь в кубической системе с плотностью 5,85 г/см3 (α – модификация). Подобные превращения свойственны многим другим элементам.
Химическую активность металлов можно характеризовать положением в электрохимическом ряду напряжений, где металлы размещены в порядке нарастания нормальных электрохимических или электродных потенциалов. Чем больше алгебраическая величина нормального электродного потенциала, тем меньше восстановительная способность и химическая активность металла. В ряду напряжений каждый металл способен вытеснять стоящие правее него металлы из водных растворов и солевых расплавов.
Металлы с отрицательными электрохимическими потенциалами легко подвержены окислению, поэтому они встречаются в природе только в виде химических соединений: оксидов, галогенидов, а также сульфидов, силикатов и других солей. По мере повышения потенциала, а значит и снижения химической активности, свободное состояние металлов становится все более устойчивым. Например, медь, серебро и ртуть находятся в природе не только в виде солей, но и в свободном состоянии, а золото и платина – преимущественно в свободном состоянии. Связь между электродными потенциалами и некоторыми свойствами металлов показана (табл. 2).
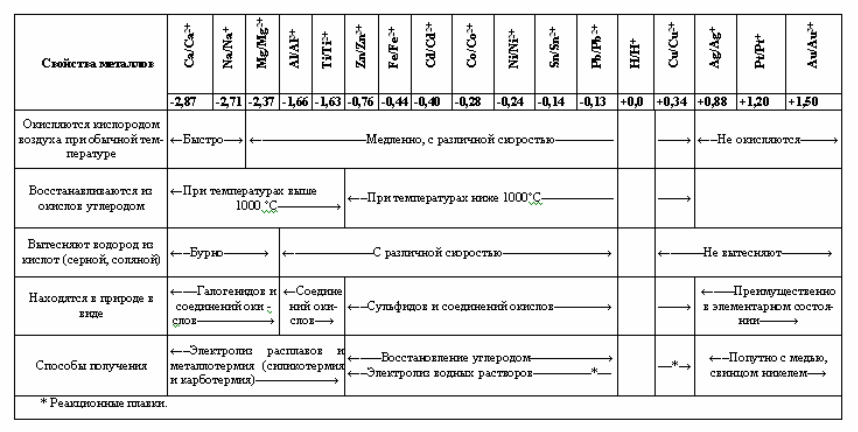 Ряд напряжений и некоторые свойства металлов
Ряд напряжений и некоторые свойства металлов
Характеризуя металлы как химические элементы надо заметить, что Периодическая система Д. И. Менделеева не позволяет четко различить их от металлоидов и неметаллов. Это и естественно: каждый элемент представляет собой диаэлектрическое единство металлических и металлоидных свойств, противоречивая природа которых не устраняется с ростом заряда ядра и количества электронных оболочек.
Явными неметаллами легко признать водород, благородные газы, галогены, элементы группы VI – кислород, серу, селен, теллур и полоний, а также бор, углерод, азот, кремний и фосфор. Все они не дают основных оксидов и гидрооксидов, свойственных металлам. Вместе с тем из числа прочих элементов некоторые имеют амфотерные гидрооксиды. В частности, у таких, казалось бы, явных металлов, как цинк и алюминий, оксиды проявляют и кислотные и основные свойства.
О кристаллических решетках металлов в общем случае говорилось выше, а для большинства химических элементов они условно показаны в табл. 4. Однако различие кристаллических структур также не дает оснований для интересующего нас подразделения элементов. Привычно считаемые металлами ртуть, и висмут кристаллизуются в несвойственной большинству других металлов ромбической системе, а индий и олово – в тетрагональной.
Наиболее четкую условную границу между металлами и металлоидами можно провести, сравнивая электропроводность или обратную ей величину – удельное электрическое сопротивление. Для явного металла – никеля удельное электрическое сопротивление равно 6,8∙10–6 (Ом∙см), а для металлоида углерода только в модификации графита составляет 1375∙10–6 (Ом∙см).
Ориентируясь по этому признаку, к металлам следует отнести 80 элементов, а к неметаллам и металлоидам 23.
Далее, ограничивая область металлургии элементами, входящими в состав земной коры, из восьмидесяти следует исключить франций, технеций, прометий, а также актиниды, начиная с америция, и определить окончательное число металлов, равным 68 (таб. 3).
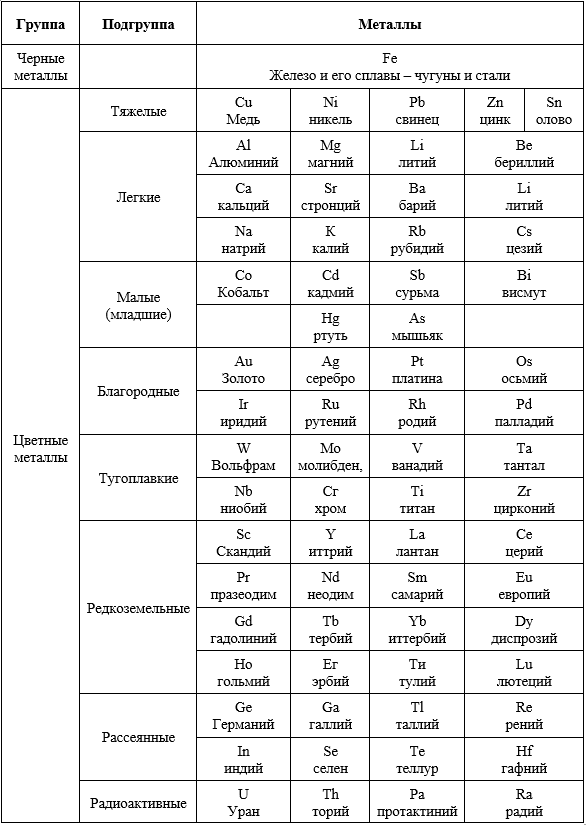 Таблица 3
Таблица 3
Промышленная классификация металлов
в связи со стремлением к комплексности использования сырья, а также широким производством сплавов, часто включающих металлоиды, сложились традиции, по которым к металлам иногда неправильно относят кремний, германий, а иногда также селен и теллур, попутно извлекаемые из металлургического сырья. Наряду с этим типичный металл – натрий получает химическая промышленность; из этого видна тесная связь химии с металлургией. Раньше металлургию отличало от химической технологии преимущественное применение плавок при высоких температурах, теперь эта особенность все более утрачивается: наряду с огневой пирометаллургией возрастает значение гидрометаллургии, которая извлекает металлы из руд выщелачиванием водными растворами реагентов с последующим восстановлением электролизом либо цементацией.
В качестве промежуточных переделов для разделения и концентрирования растворенных веществ пользуются сорбцией, экстракцией, осаждением, соосаждением и другими способами химической переработки.
Промышленная классификация металлов, традиционно сложившаяся в нашей стране в период наиболее интенсивной индустриализации, не имеет четкой научной основы, но широко применяется в технической литературе и обиходе. Первое основание ее, принятое и в некоторых других странах, состоит в резком различии масштабов производства железа и прочих металлов. В общей массе металлургической продукции, сплавы железа занимают около 93%. Поэтому различают «железные металлы» (железо и его сплавы – чугуны и стали) и прочие «нежелезные».
У нас этому соответствуют условно принятые названия черные и цветные металлы. Цветные металлы в свою очередь подразделяются по некоторым общим признакам на ряд групп и подгрупп, отмеченных в табл.3 и 4.

В вышеприведенной классификации нет даже принципа названий групп. Так, в конце прошлого столетия алюминий считали редким металлом, а сейчас по производству и потреблению он занимает первое место среди цветных металлов. Не решен окончательно вопрос и с титаном, так как некоторые металлурги относят его к тугоплавким редким металлам, а другие к легким металлам. Поэтому различные металлурги, придерживаясь разных точек зрения, относят отдельные металлы к разным группам.